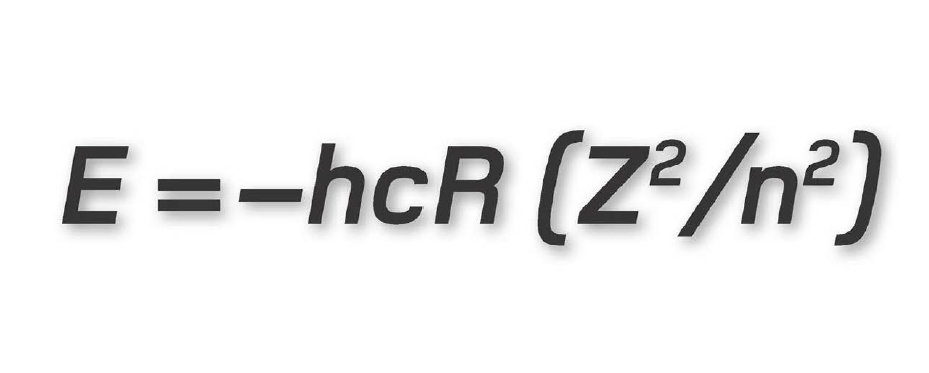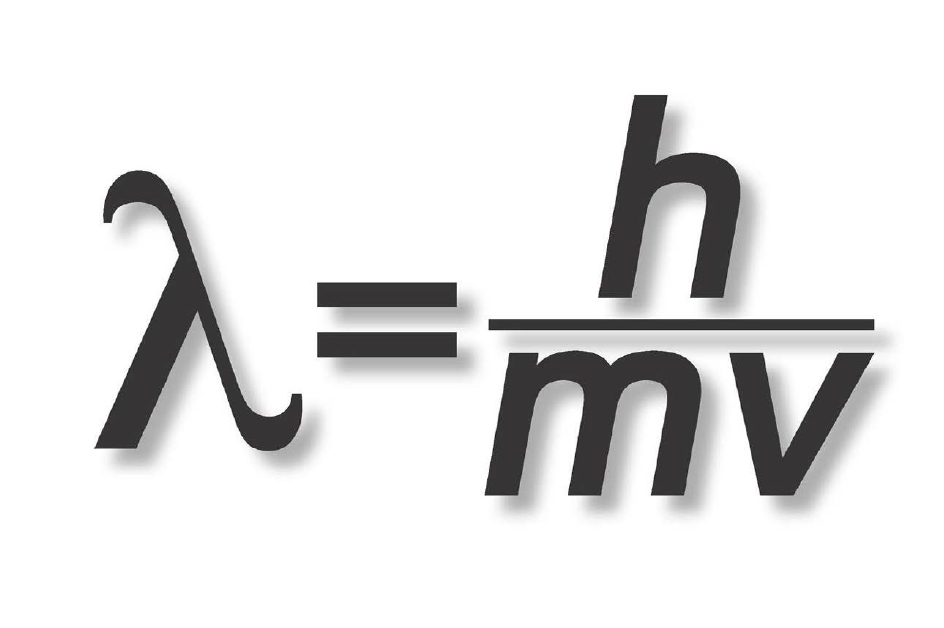Cấu trúc nguyên tử của Rutherford
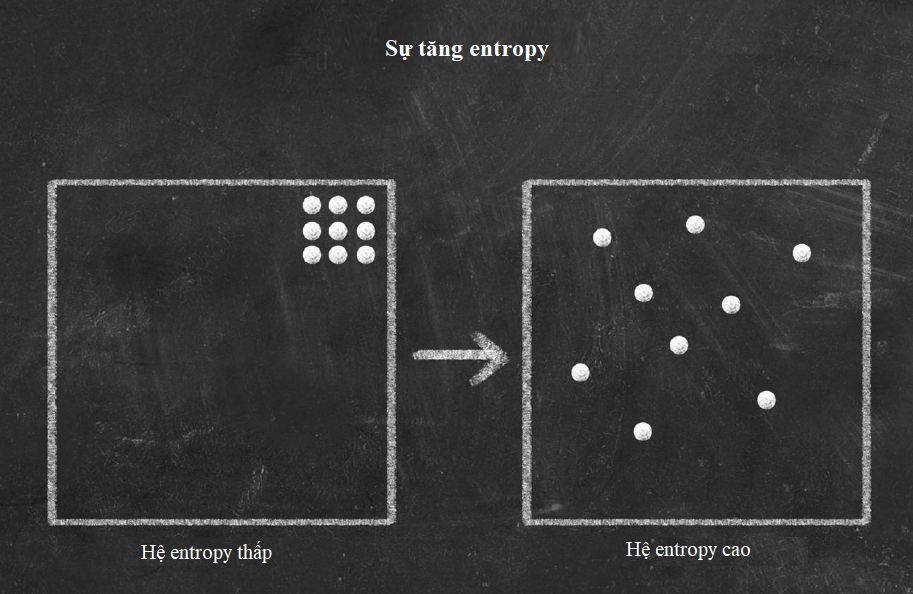
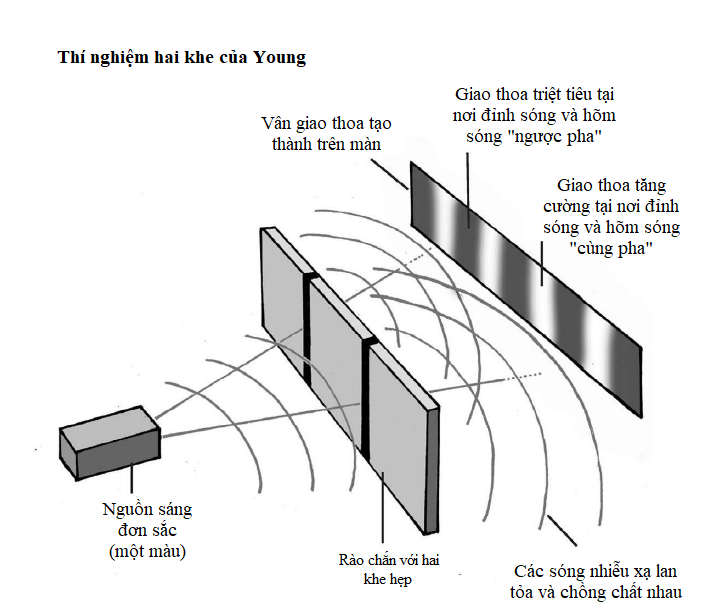
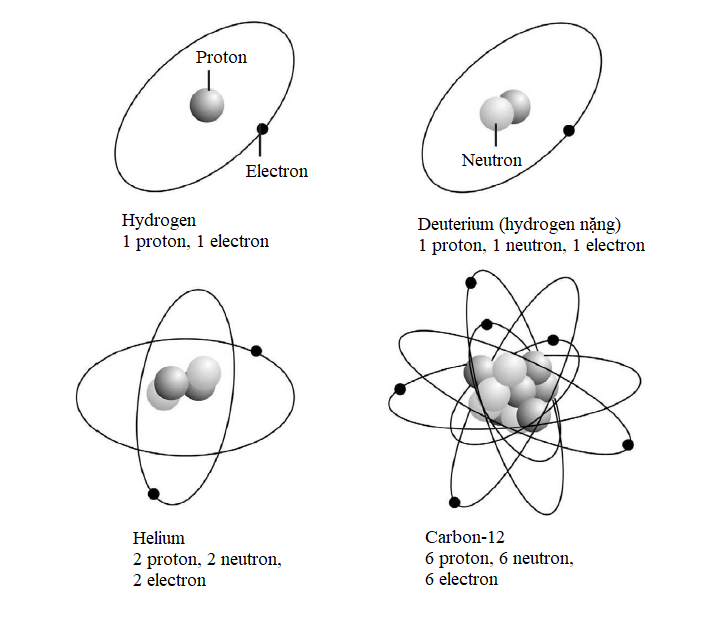
Lưỡng tính sóng-hạt chứng minh rằng thuyết lượng tử không những áp dụng được cho ánh sáng, mà còn cho các nguyên tử và các hạt dưới nguyên tử. Vậy nhận thức của chúng ta về những hạt này đã phát triển như thế nào? Sau khi khám phá electron, J.J. Thomson đã đề xuất một mô hình đơn giản của nguyên tử với các electron tích điện âm nhấn chìm trong một không gian tích điện dương, giống như những hạt nhân nho trong bánh bông lan.
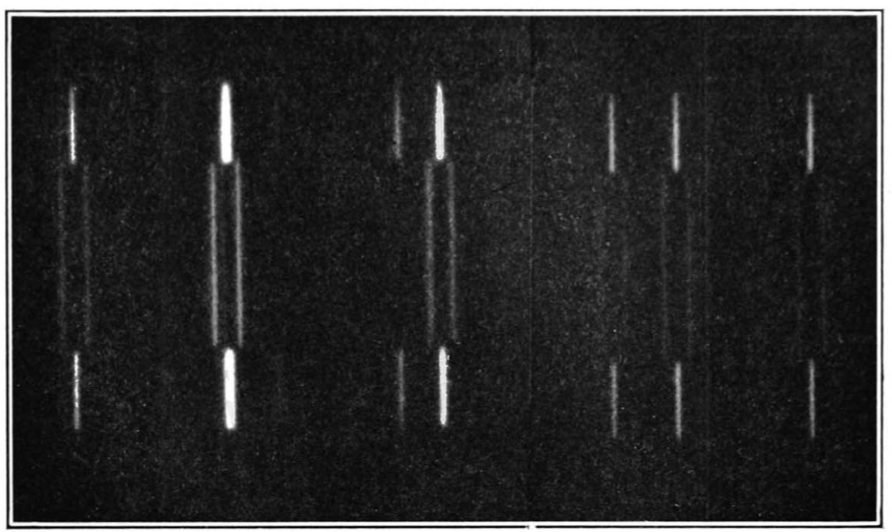
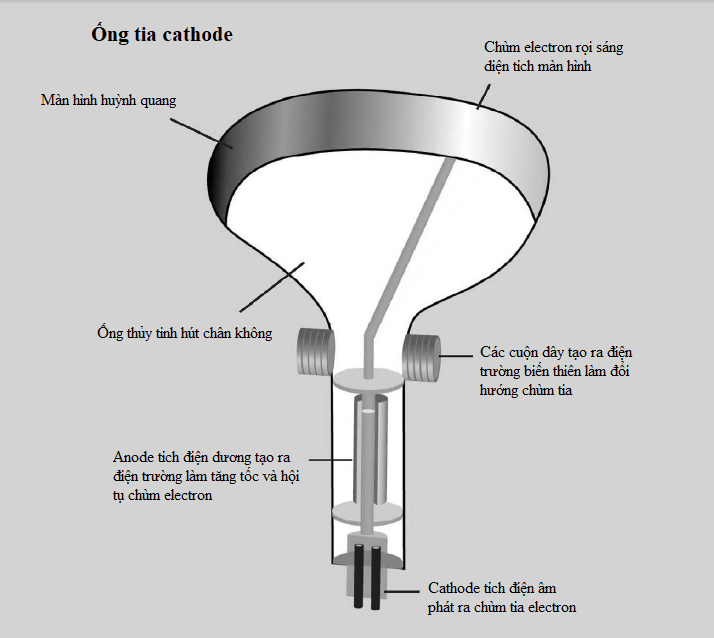
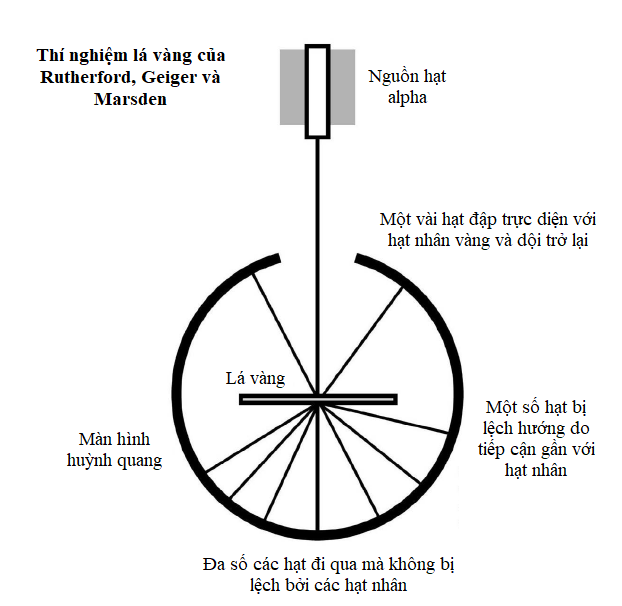
Tuy nhiên, vào năm 1908, Ernest Rutherford, Hans Geiger và Ernest Marsden phát hiện một câu chuyện phức tạp hơn. Trong một thí nghiệm nổi tiếng, họ bắn các hạt alpha phóng xạ qua một lá vàng mỏng về phía một màn hình huỳnh quang sẽ sáng lên khi có một hạt đập vào. Phần lớn các hạt alpha đi thẳng qua lá vàng, nhưng một số hạt có đường đi của chúng bị lệch chút ít, và những hạt khác thì bị dội ngược lại. Hành trạng như thế là không thể giải thích được trong mô hình “bánh bông lan rắc nho”, vì thế đội Rutherford nhận thấy phần lớn vật chất trong nguyên tử bị nén vào một hạt nhân nhỏ xíu ở giữa, ngày nay hạt nhân này được biết là gồm những hạt còn nhỏ hơn nữa gọi là proton và neutron.
Cấu trúc nguyên tử của Bohr
Mẫu nguyên tử được đề xuất bởi thí nghiệm lá vàng của Rutherford vốn dĩ không bền. Trong mô hình của ông, các electron sẽ mất năng lượng, chuyển động xoắn ốc vào trong và va chạm với hạt nhân tích điện dương, làm phát ra ánh sáng trên toàn phổ bước sóng liên tục khi chúng hành xử như thế. Nhưng, trong thực tế, các nguyên tử vẫn bền vững và ánh sáng mà các electron phát ra chỉ theo những lượng tử rời rạc.
Chính nhà vật lí Đan Mạch Niels Bohr là người bắt đầu nhận thức ra vấn đề này bằng cách áp dụng thuyết lượng tử mới ra đời cho nó. Ông mô tả các electron chỉ chuyển động tròn trong những quỹ đạo bền, mỗi quỹ đạo có một mức năng lượng riêng. Để một electron nhảy sang một quỹ đạo thấp hơn, nó phải từ bỏ một phần năng lượng, giải phóng một photon có năng lượng bằng với hiệu năng lượng giữa hai quỹ đạo. Tương tự như vậy, để nhảy lên một quỹ đạo cao hơn, mỗi electron phải hấp thụ một photon có năng lượng vừa đủ. Đây là lí thuyết cơ bản làm nền tảng khoa học của máy quang phổ, và hiệu giữa các mức năng lượng được cho bởi một phương trình được gọi là liên hệ Planck.

Vật lí Lượng tử Tốc hành | Gemma Lavender
Phần tiếp theo >>