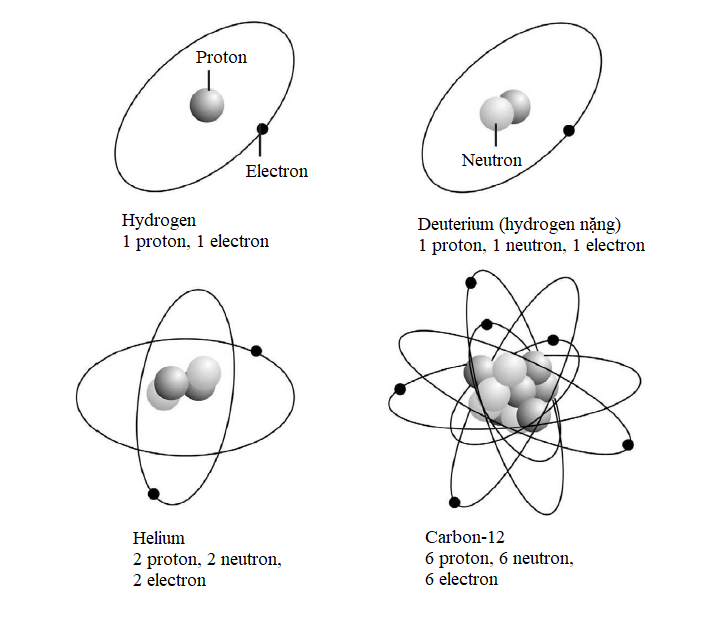
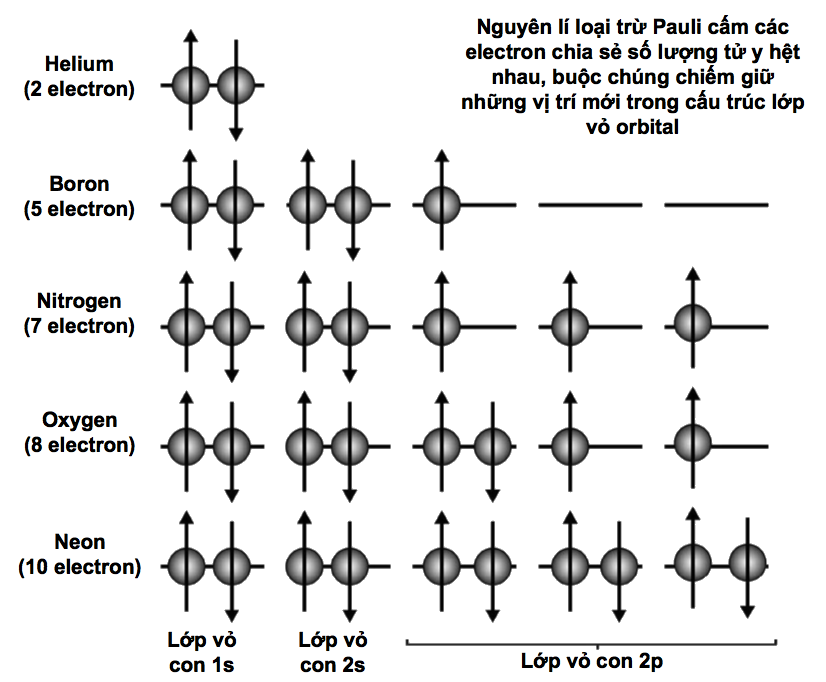
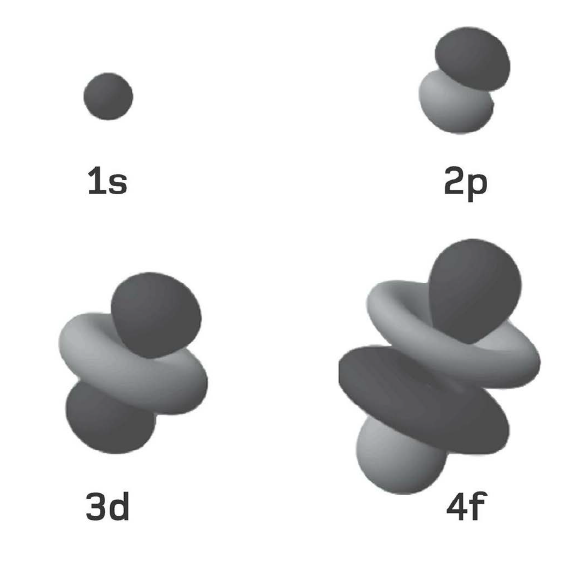
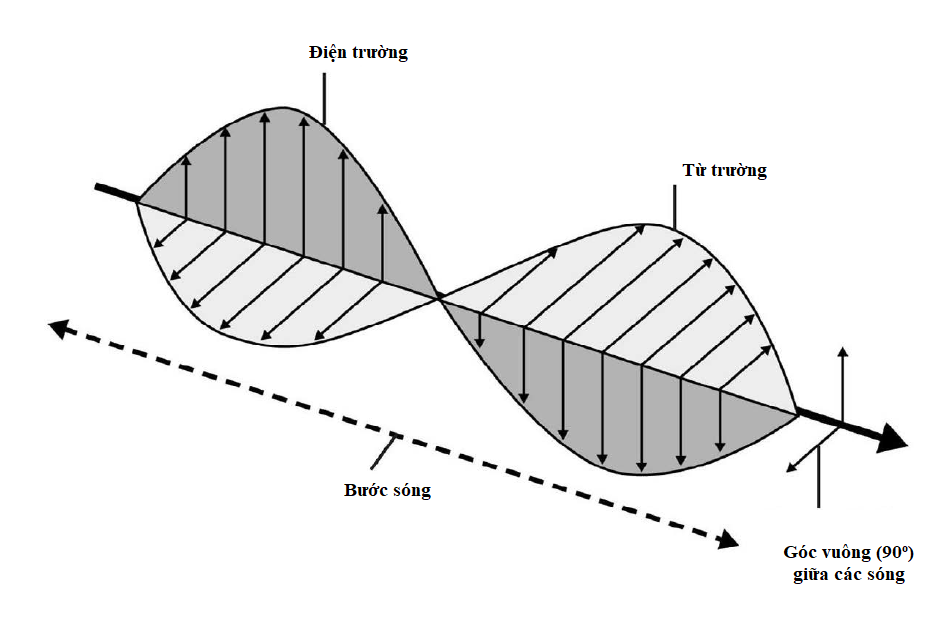
Tính các mức năng lượng
Khi phân tích quang phổ, các nhà vật lí thường phải tính các mức năng lượng gần đúng của electron trong một lớp vỏ nhất định, và họ làm công việc này bằng cách sử dụng phương trình sau.
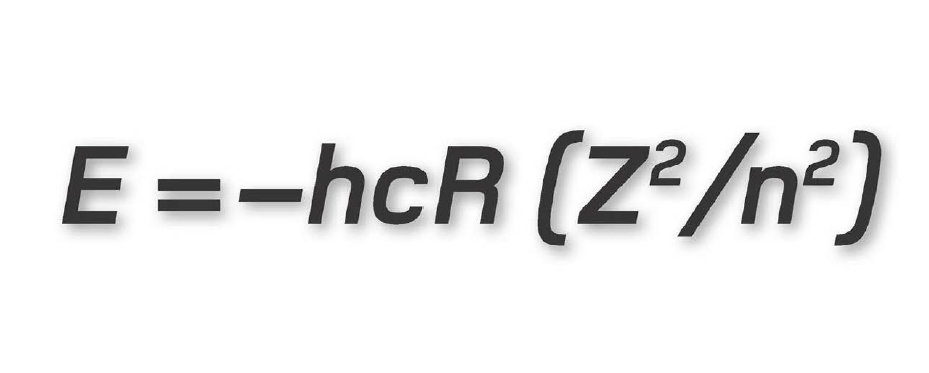
Ở đây, E kí hiệu cho năng lượng mà ta muốn tính, h là hằng số Planck và c là tốc độ ánh sáng, 2,998 ´ 108 m/s. R là một hệ số gọi là hằng số Rydberg có giá trị số bằng 1,097 ´ 107, Z là số nguyên tử (số proton hay electron trong một nguyên tử) và n là số lượng tử chính. Trong ví dụ trước đây của chúng ta về nguyên tử argon, Z = 18, vì thế nếu ta muốn tính năng lượng của lớp vỏ M (n = 3), thì ta chỉ việc nhân các con số với nhau:
E = 6,626 ´ 10-34 ´ (1,998 ´ 108) ´ (1,097 ´ 107) ´ (182/32)
Kết quả là 7,845 ´ 10-17 joule. Các nhà vật lí lượng tử ưa làm việc với những đơn vị năng lượng nhỏ hơn, họ phiên dịch kết quả này ra electron-volt (năng lượng cần thiết để di chuyển một electron độc thân qua hiệu điện thế 1 volt), kết quả trong trường hợp này là E = - 489,78 eV.
Trạng thái cơ bản
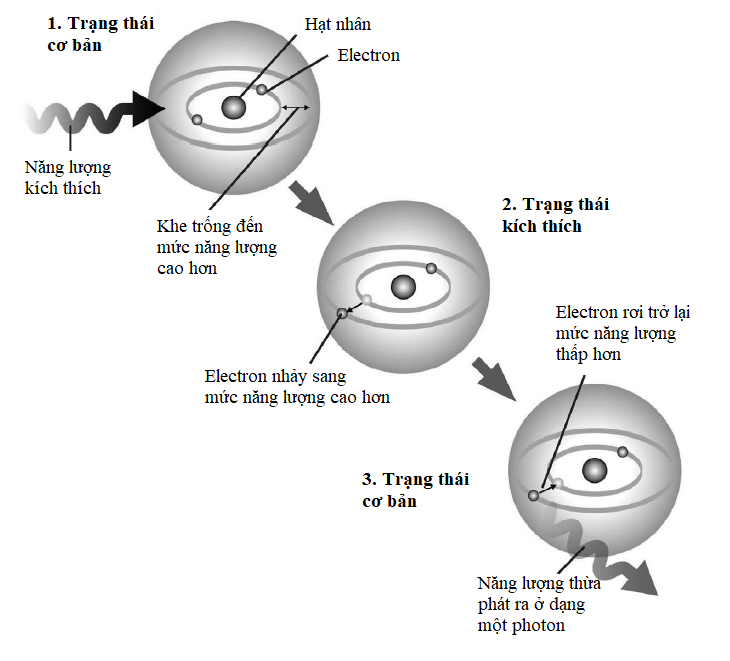
Các electron năng lượng thấp nhất trong mỗi nguyên tử (các electron thuộc lớp vỏ K trong cùng) thỉnh thoảng được mô tả là đang ở trạng thái cơ bản: năng lượng của chúng không thể hạ thấp hơn và, nói chung, chúng đã chạm tới ‘đất’ rồi. Mặt khác, những electron ở những mức năng lượng cao hơn với năng lượng dư của chúng được mô tả là ‘bị kích thích’.
Sự khác biệt giữa các electron trạng thái cơ bản và trạng thái kích thích là chìa khóa ẩn sau nhiều hiện tượng vật lí lượng tử xảy ra trong các lớp vỏ electron. Khi một electron thu năng lượng bằng cách hấp thụ một photon, nó trở nên bị kích thích và cố nhảy lên một mức năng lượng nào đó cao hơn. Ngược lại, khi một electron mất năng lượng, nó phát ra một photon và rơi trở xuống một mức năng lượng thấp hơn. Vì sao hạt electron cứ phải rơi trở xuống chứ? Mọi hạt vật chất đều ổn định nhất khi chúng càng ở gần trạng thái cơ bản càng tốt, vì thế các electron kích thích vốn dĩ không bền. Nếu có một khoảng trống trong lớp vỏ electron bên dưới nó, thì lập tức electron sẽ cho đi năng lượng dư để chiếm giữ khoảng trống đó ngay.
Vật lí Lượng tử Tốc hành | Gemma Lavender
Phần tiếp theo >>
Tính các mức năng lượng
Khi phân tích quang phổ, các nhà vật lí thường phải tính các mức năng lượng gần đúng của electron trong một lớp vỏ nhất định, và họ làm công việc này bằng cách sử dụng phương trình sau.