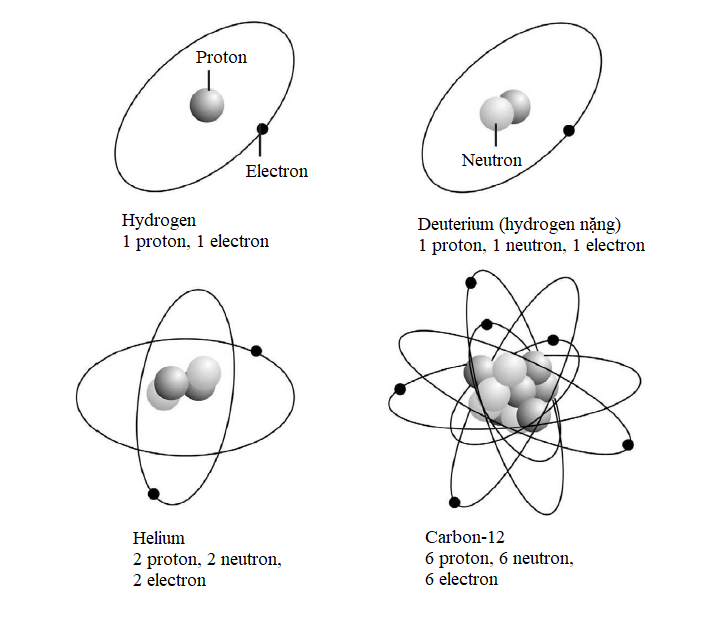
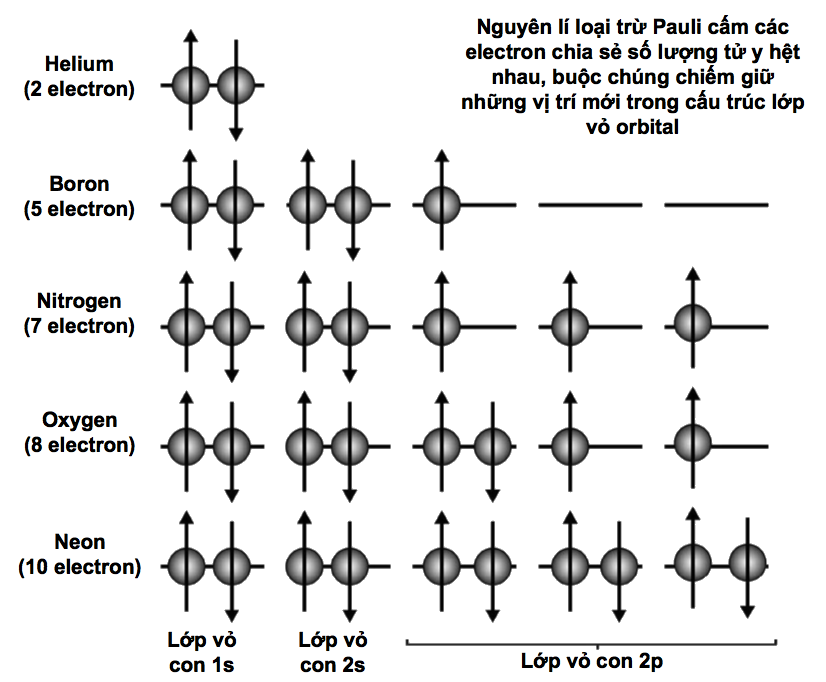
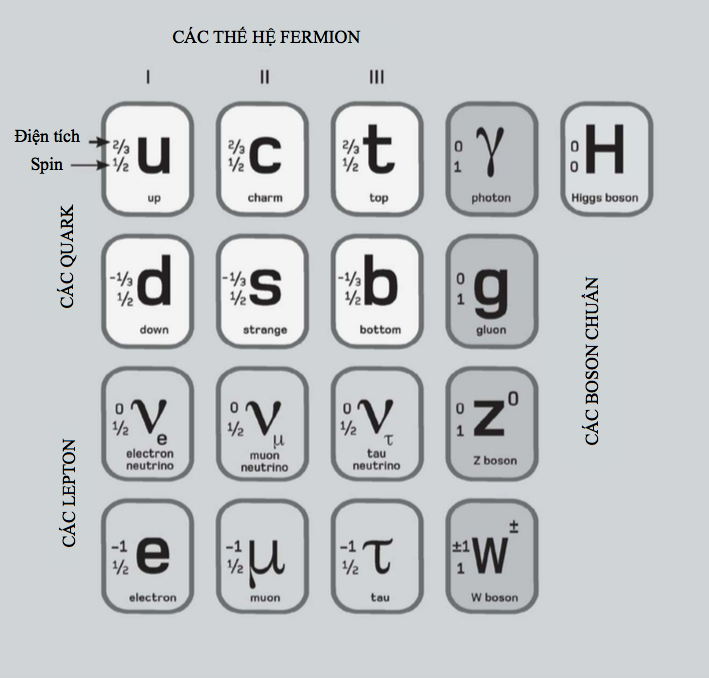
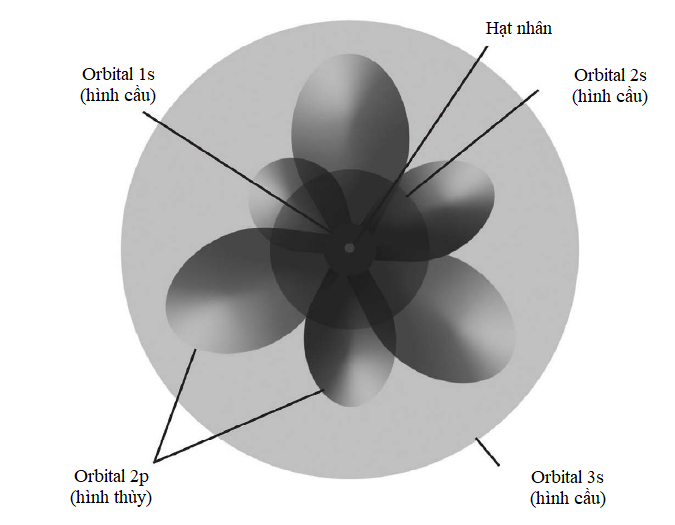
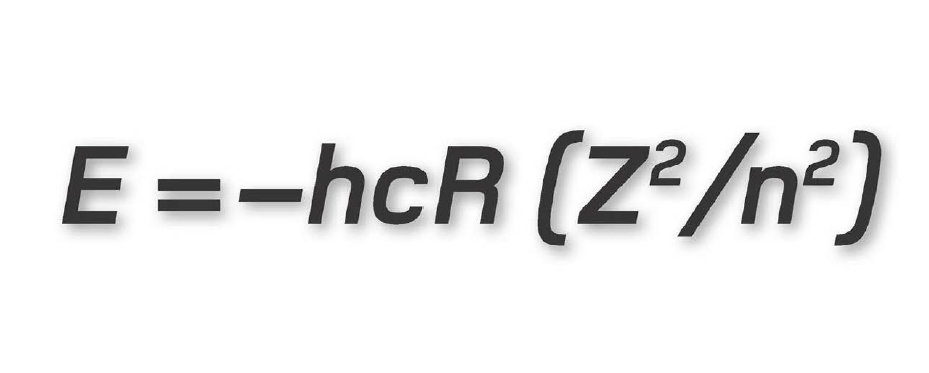Các lớp vỏ con electron
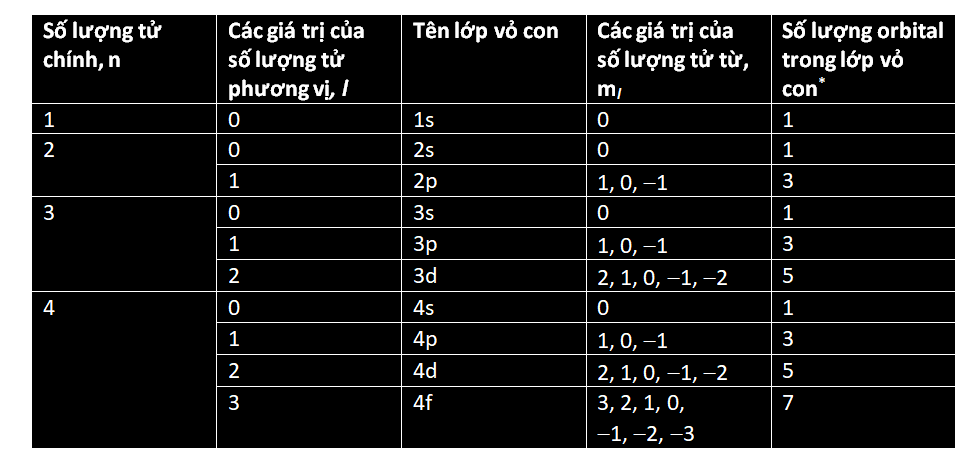
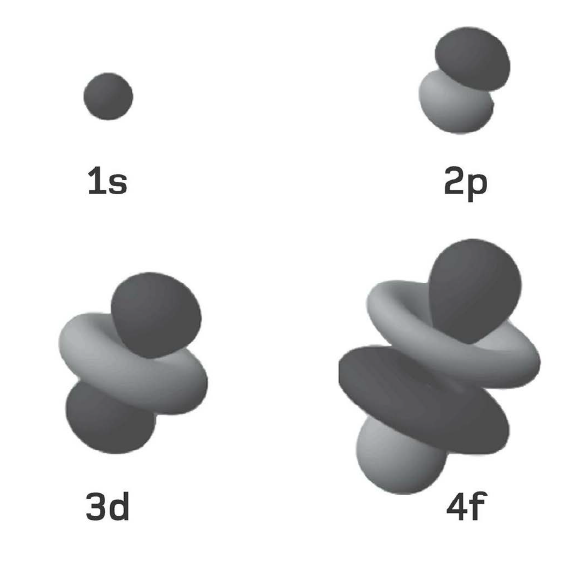
Theo phương trình đã nêu ở phần trước thì các electron thuộc cùng một lớp vỏ có năng lượng y hệt nhau, nhưng điều này không hoàn toàn đúng; vì như thường xảy ra, vật lí lượng tử có một số tùy tiện. Mỗi lớp vỏ electron được phân chia thành những lớp con, một trong số chúng sẽ có năng lượng được tính bằng phương trình đã nêu, còn những lớp con khác sẽ sai lệch chút ít xung quanh năng lượng đó. Mỗi electron trong một lớp vỏ electron cho trước có thể tồn tại trong bất kì lớp con nào. Các lớp con được phân biệt bằng các chữ cái – s, p, d, f và tuần tự theo bảng chữ cái, g, h, i, vân vân. Lớp vỏ K trong cùng chỉ có một lớp con gọi là 1s. Lớp thứ hai, L, có hai lớp con, 2s và 2p; lớp thứ ba, lớp M, có ba lớp con, 3s, 3p, và 3d, và vân vân.
Các lớp con phát sinh là do hàm sóng electron cho phép một khoảng sai lệch nhỏ trong phân bố không gian của chúng – mỗi electron sẽ có một xác suất cho trước để tồn tại ở một lớp con nào đó. Đặc biệt, lớp con đó được tính bằng phương trình sóng Schrodinger nổi tiếng (xem phần sau).
Hình dạng tổng quát của từng lớp con s, p, d và f
Suy thoái lượng tử
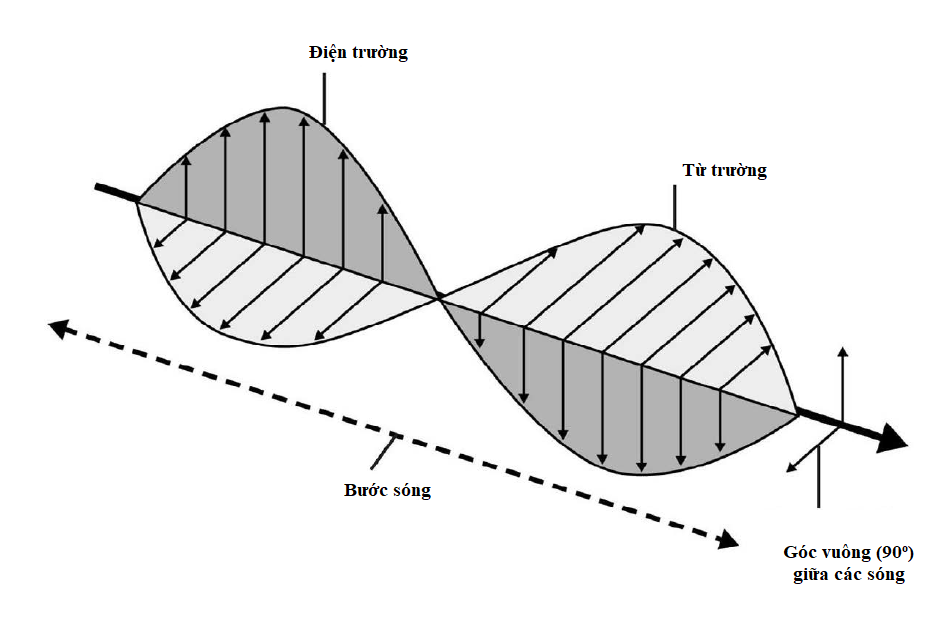
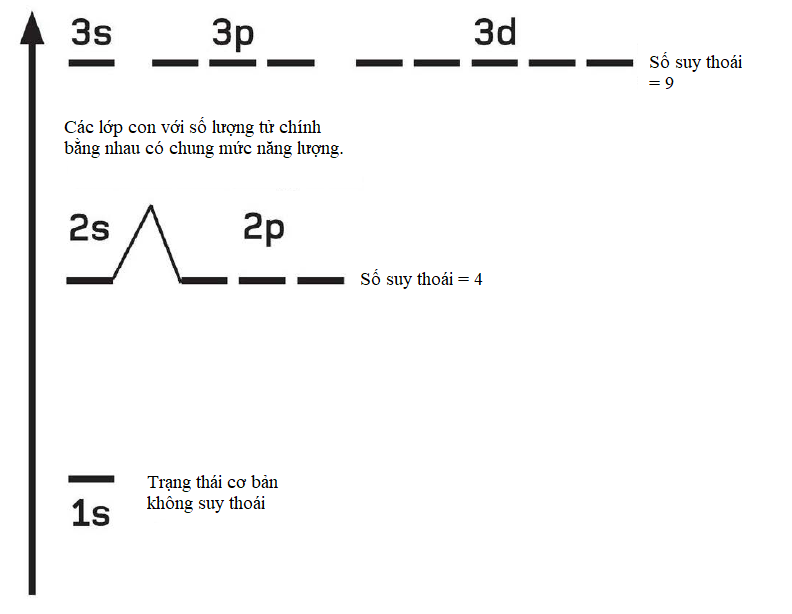
Các mô hình toán học gọi ‘dao động tử điều hòa’ là yếu tố vạn vật trong vật lí học, vì nó đem lại một cách mô tả nhiều hiện tượng dao động và dạng sóng. Loại dao động tử đơn giản nhất là một vật nặng gắn với một đầu lò xo, chạy tới chạy lui trong một chiều không gian. Tuy nhiên, xét một dao động ba chiều, và dao động thực hiện theo chiều lên xuống, trái phải và trước sau. Nếu cả ba trạng thái dao động đều có biên độ và năng lượng bằng nhau, thì hệ được mô tả là ‘suy thoái’; ta cần ít con số hơn so với trông đợi để mô tả nó.
Tương tự như vậy, vật lí lượng tử có khái niệm suy thoái riêng của nó áp dụng khi có nhiều hơn một trạng thái lượng tử cùng chia sẻ mức năng lượng bằng nhau trong một lớp vỏ electron. Số suy thoái lượng tử cho biết có bao nhiêu số lượng tử có thể có năng lượng bằng nhau, và được cho bởi bình phương của số lượng tử chính. Trong nguyên tử hydrogen, mỗi electron trạng thái cơ bản có số suy thoái đúng bằng 1, nhưng nếu electron đó được tăng năng lượng sang lớp vỏ L, thì số suy thoái của nó thành 4 (22); sang lớp vỏ M là 9 (32).
Vật lí Lượng tử Tốc hành | Gemma Lavender
Phần tiếp theo >>