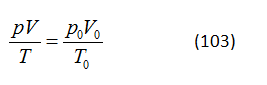Chúng tôi trích giới thiệu với các bạn một số bản dịch từ tác phẩm Những câu hỏi và bài tập vật lí phổ thông của hai tác giả người Nga L. Tarasov và A. Tarasova, sách xuất bản ở Nga năm 1968. Bản dịch lại từ bản tiếng Anh xuất bản năm 1973.
Các bài giảng được trình bày dưới dạng thảo luận hỏi đáp giữa giáo viên và học sinh.
§20. Các định luật chất khí (Phần 2)
>> Xem Phần 1
GV: Trong trường hợp đó, chúng ta hãy tiếp tục nào. Xét ví dụ sau đây. Một chất khí giãn nở sao cho áp suất và thể tích của nó thỏa mãn điều kiện
pV2 = const (110)
Chúng ta xác định xem chất khí nóng lên hay lạnh đi trong một sự giãn nở như thế.
HS A: Tại sao nhiệt độ của chất khí đó phải thay đổi?
GV: Nếu nhiệt độ là không đổi, thì điều đó có nghĩa là chất khí giãn nở theo định luật Boyle và Mariotte [phương trình (107)]. Trong một quá trình đẳng nhiệt, p µ (1/V), còn trong trường hợp của chúng ta sự phụ thuộc của p vào V theo một bản chất khác: p ˜ (1/V2).
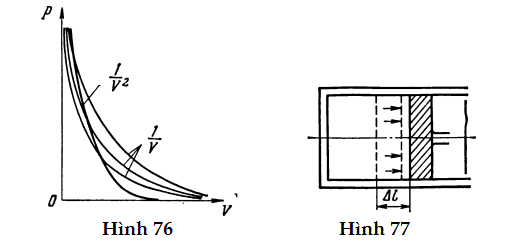
HS A: Có lẽ em nên thử vẽ đồ thị biểu diễn những liên hệ này? Các đường cong sẽ có dạng như ở Hình 76.
GV: Đó là một ý hay. Vậy những đường cong đó cho thấy gì nào?
HS A: Giờ thì có vẻ như em đã hiểu. Ta có thể thấy rằng lần theo đường cong p µ (1/V2) về phía thể tích tăng, thì chất khí sẽ từ từ cắt qua các đường đẳng nhiệt càng gần gốc tọa độ hơn, tức là những đường đẳng nhiệt tương ứng với nhiệt độ giảm dần. Điều này có nghĩa là trong quá trình giãn nở này chất khí lạnh đi.
GV: Khá chính xác. Tôi sẽ chỉ nhắc lại phần trả lời của em. Tốt hơn là nên nói một quá trình giãn nở chất khí như vậy sẽ chỉ làm cho chất khí lạnh đi.
HS B: Ta có thể đi tới kết luận giống như vậy bằng phương pháp giải tích hay không?
GV: Tất nhiên. Ta hãy xét hai trạng thái của chất khí: p1, V1, T1 và p2, V2, T2. Tiếp theo ta sẽ viết phương trình định luật chất khí kết hợp [xem phương trình (104)] cho mỗi trạng thái này:

Theo phương trình này, rõ ràng là nếu, ví dụ, thể tích chất khí tăng lên gấp đôi thì nhiệt độ của nó (theo thang nhiệt độ tuyệt đối) giảm đi một nửa.
HS A: Phải chăng như vậy có nghĩa là cho dù quá trình nào, các thông số chất khí (p, V và T) sẽ liên hệ với nhau trong mỗi trường hợp theo định luật chất khí kết hợp?
GV: Chính xác. Định luật chất khí kết hợp xác lập một mối liên hệ giữa các thông số chất khí bất chấp quá trình được xét tới.
Bây giờ chúng ta hãy xét bản chất của sự trao đổi năng lượng giữa một chất khí và môi trường của nó trong những quá trình khác nhau. Giả sử chất khí đó đang giãn nở. Nó sẽ tác dụng lực lên mọi vật kìm hãm thể tích của nó (ví dụ như cái piston trong một xilanh). Hệ quả là chất khí thực hiện công lên những vật này. Công này chẳng khó tính đối với sự giãn nở đẳng áp của chất khí. Giả sử chất khí giãn nở đẳng áp và đẩy một piston tiết diện S dịch một đoạn Δl (Hình 77). Áp suất do chất khí tác dụng lên piston là p. Tìm lượng công do chất khí thực hiện làm dịch chuyển piston:
A = FΔl = (pS) Δl = p (SΔl) = p(V2 – V1) (112)
Trong đó V1 và V2 là thể tích ban đầu và thể tích lúc sau của chất khí. Công do chất khí thực hiện trong quá trình phi đẳng áp thì khó tính hơn bởi vì áp suất biến thiên trong quá trình chất khí giãn nở. Trong trường hợp tổng quát, công thực hiện bởi chất khí khi thể tích của nó tăng từ V1 đến V2 bằng diện tích nằm dưới đường cong p(V) giữa tọa độ V1 và V2. Công thực hiện bởi chất khí trong quá trình giãn nở đẳng áp và đẳng nhiệt từ thể tích V1 đến thể tích V2 được biểu diễn tương ứng trên Hình 78 bởi toàn bộ phần diện tích gạch chéo và phần gạch ca rô. Trạng thái cuối là như nhau trong cả hai trường hợp.

Như vậy, khi giãn nở, chất khí thực hiện công lên những vật xung quanh, làm tiêu hao một phần nội năng của nó. Công thực hiện bởi chất khí phụ thuộc vào bản chất của quá trình giãn nở. Cũng nên lưu ý rằng, nếu chất khí bị nén thì có công thực hiện trên chất khí và, do đó, nội năng của nó tăng.
Tuy nhiên, sự xuất hiện của công không phải là phương pháp duy nhất trao đổi năng lượng giữa một chất khí và môi trường. Ví dụ, trong giãn nở đẳng nhiệt, một chất khí thực hiện một công A nhất định và, do đó, tiêu hao một phần năng lượng bằng với công A. Tuy nhiên, mặt khác, theo các nguyên lí đã nêu ở §18 [xem phương trình (98)], một nhiệt độ không đổi của một chất khí trong quá trình đẳng nhiệt nghĩa là nội năng U của nó không đổi (tôi nhắc lại với các em rằng U được xác định bởi chuyển động nhiệt của các phân tử và năng lượng trung bình của các phân tử tỉ lệ với nhiệt độ T). Câu hỏi đặt ra là: loại năng lượng nào dùng để thực hiện công trong trường hợp đã cho?
HS B: Rõ ràng là nhiệt từ bên ngoài truyền cho chất khí.
GV: Đúng. Bằng cách này, chúng ta đi tới kết luận rằng một chất khí trao đổi năng lượng với môi trường thông qua ít nhất hai kênh: bằng cách thực hiện công đi kèm với sự biến thiên thể tích của chất khí, và bằng cách truyền nhiệt.
Sự cân bằng năng lượng có thể được biểu diễn dưới dạng sau:
ΔU = Q – A (113)
Trong đó ΔU là độ tăng nội năng của chất khí được đặc trưng bởi độ tăng nhiệt độ của nó, Q là nhiệt từ môi trường xung quanh truyền cho chất khí, và A là công do chất khí thực hiện lên những vật xung quanh. Phương trình (113) được gọi là định luật thứ nhất của nhiệt động lực học. Lưu ý rằng nó có tính vạn vật và có khả năng áp dụng không chỉ cho các chất khí, mà còn cho bất kì vật nào khác.
HS B: Nói tóm lại, chúng ta có thể kết luận rằng, trong sự giãn nở đẳng nhiệt, toàn bộ nhiệt truyền cho chất khí tức thời biến đổi thành công do chất khí thực hiện. Như vậy, các quá trình đẳng nhiệt không thể xảy ra trong một hệ cô lập nhiệt.
GV: Khá chính xác. Bây giờ hãy xét sự giãn nở đẳng áp của chất khí từ quan điểm năng lượng.
HS B: Chất khí giãn ra. Điều đó có nghĩa là nó thực hiện công. Ở đây, như có thể thấy từ phương trình (106), nhiệt độ của chất khí tăng lên, tức là nội năng của nó tăng lên. Như vậy, trong trường hợp này, một lượng nhiệt tương đối lớn phải được truyền cho chất khí: một phần nhiệt này được dùng để làm tăng nội năng của chất khí và phần còn lại biến đổi thành công thực hiện bởi chất khí.
GV: Rất tốt. Xét thêm một ví dụ nữa. Một chất khí được nung nóng sao cho nhiệt độ của nó tăng thêm DT. Quá trình này được thực hiện hai lần: một lần thể tích không đổi và lần sau áp suất không đổi. Hỏi chúng ta có tiêu hao lượng nhiệt như nhau để làm nóng chất khí trong cả hai trường hợp hay không?
HS A: Em nghĩ là như nhau.
HS B: Theo em lượng nhiệt tiêu hao là khác nhau. Ở thể tích không đổi, không có công nào được thực hiện, và toàn bộ nhiệt tiêu hao để làm tăng nội năng của chất khí, tức là làm tăng nhiệt độ của nó. Trong trường hợp này
Q1 = C1ΔT (114)
Ở áp suất không đổi, sự nóng lên của chất khí luôn đi kèm với sự giãn nở của nó, cho nên lượng công thực hiện là A = p(V – V1). Nhiệt cung cấp Q2 một phần dùng để làm tăng nội năng của chất khí (tăng nhiệt độ của nó) và một phần để thực hiện công này. Như vậy
Q2 = C1ΔT + p(V – V1) (115)
Rõ ràng Q1 < Q2.
GV: Tôi đồng ý với em B. Thế các em gọi lượng nhiệt cần thiết dùng để làm tăng nhiệt độ của một vật lên thêm một độ là gì?
HS B: Nhiệt dung của vật.
GV: Ta có thể kết luận gì từ ví dụ vừa nêu khi xét nhiệt dung của một chất khí?
HS B: Một chất khí có hai nhiệt dung khác nhau: ở thể tích không đổi và ở áp suất không đổi. Nhiệt dung ở thể tích không đổi (hệ số C1 trong hai phương trình trên) nhỏ hơn nhiệt dung ở áp suất không đổi.
GV: Các em có thể biểu diễn nhiệt dung đẳng áp theo C1, tức là theo nhiệt dung đẳng tích hay không?
HS B: Để em thử xem. Ta kí hiệu nhiệt dung đẳng áp là C2. Theo định nghĩa nhiệt dung, ta có thể viết C2 = Q2/ΔT. Thay giá trị của Q2 từ phương trình (115) vào ta được
C2 = C1 + p(V – V1)/ ΔT (116)
GV: Em dừng lại quá sớm rồi. Nếu chúng ta áp dụng phương trình của định luật chất khí kết hợp, ta có thể viết
p(V – V1) = (m/µ) R (T – T1) = (m/µ) RΔT
Sau khi thay vào phương trình (116) ta được
C2 = C1 + (m/µ) R (117)
Khi xét một phân tử gram chất khí (m = µ), thì mối liên hệ này còn đơn giản hơn nữa:
C2 = C1 + R (118)
Để kết luận, chúng ta hãy xét một chu trình nhất định gồm một đường đẳng nhiệt, một đường đẳng tích và một đường đẳng áp (xem Hình 79a trong đó các trục p và V được dùng làm các trục tọa độ). Hãy vẽ lại chu trình này (định tính) trong một hệ trục tọa độ với các trục tọa độ V và T, và phân tích bản chất của sự trao đổi năng lượng giữa chất khí và môi trường trong mỗi đoạn của chu trình.
HS B: Trong hệ trục với các trục V và T, chu trình sẽ có dạng như minh họa ở Hình 79b.
GV: Khá chính xác. Bây giờ hãy phân tích bản chất của sự trao đổi năng lượng giữa chất khí và môi trường trong mỗi đoạn riêng của chu trình.

HS B: Ở đoạn 1-2, chất khí giãn nở đẳng nhiệt. Nó nhận một lượng nhiệt từ bên ngoài và tiêu hao toàn bộ nhiệt lượng này để thực hiện công. Nội năng của chất khí không thay đổi.
Ở đoạn 2-3 của chu trình, chất khí được nung nóng đẳng tích (thể tích không đổi). Vì thể tích của nó không đổi nên không có công thực hiện. Nội năng của chất khí tăng lên chỉ do nhiệt từ bên ngoài truyền cho chất khí.
Ở đoạn 3-1, chất khí bị nén đẳng áp (áp suất không đổi) và nhiệt độ của nó giảm như có thể thấy ở Hình 79b. Có công thực hiện trên chất khí, nhưng nội năng của nó giảm. Điều này có nghĩa là chất khí truyền nhiệt mạnh cho môi trường.
GV: Lí giải của em hết sức chính xác.
HS A: Phần thảo luận của chúng ta cho em thấy em biết rất ít về các định luật chất khí. Chúng ta có cần biết hết những cái này để bước vào kì thi hay không? Theo quan điểm của em, một số câu hỏi chúng ta vừa thảo luận đã nằm ngoài khung chương trình học để thi rồi.
GV: Nếu em chịu khó suy nghĩ kĩ về những thảo luận của chúng ta, em sẽ thấy nó không chỉ bao quát những câu hỏi trực tiếp liên quan đến định luật chất khí kết hợp ở dạng khái quát của nó hoặc như đã áp dụng trong những trường hợp đặc biệt nhất định. Sự hoang mang của em không phải do sự mở rộng khung chương trình mà do thực tế em không suy nghĩ và hiểu các định luật chất khí một cách đủ thấu đáo. Thật đáng tiếc, các thí sinh thường không quan tâm chuyện hiểu sâu hơn các khái niệm rất bề ngoài của các định luật chất khí.
Những câu hỏi và bài tập vật lí phổ thông
L. Tarasov và A. Tarasova
Trần Nghiêm dịch
Phần tiếp theo >>