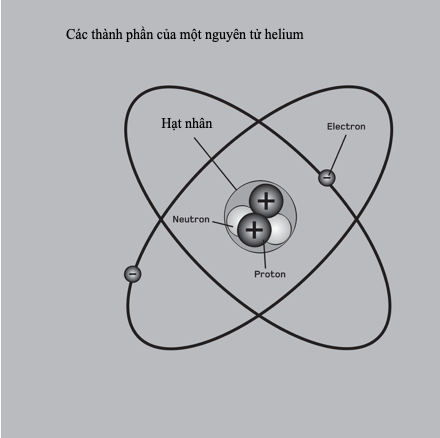
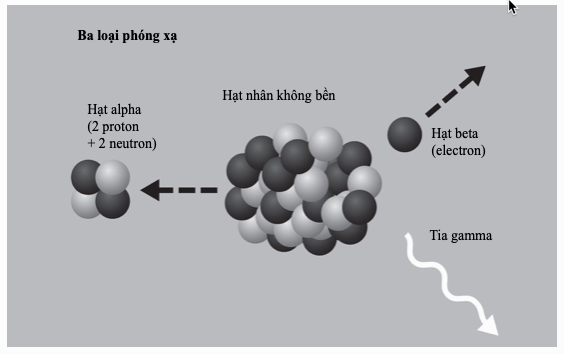
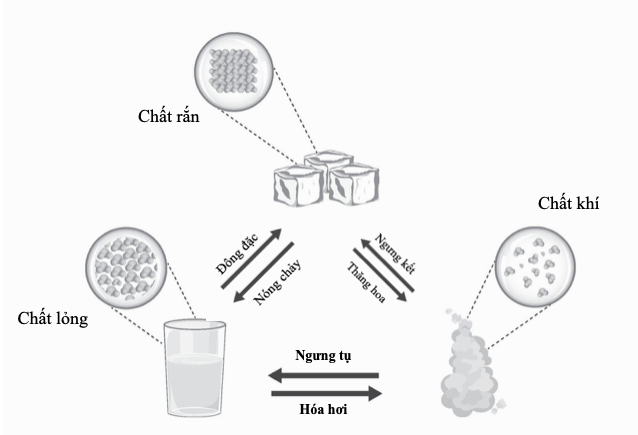
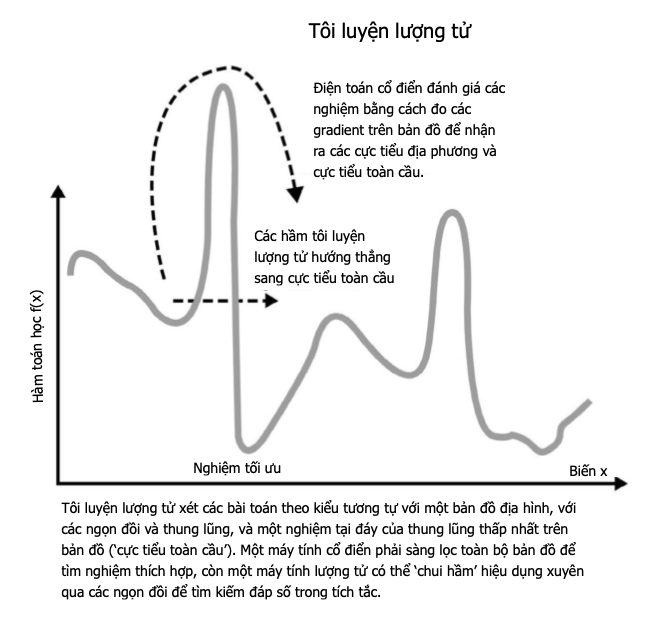
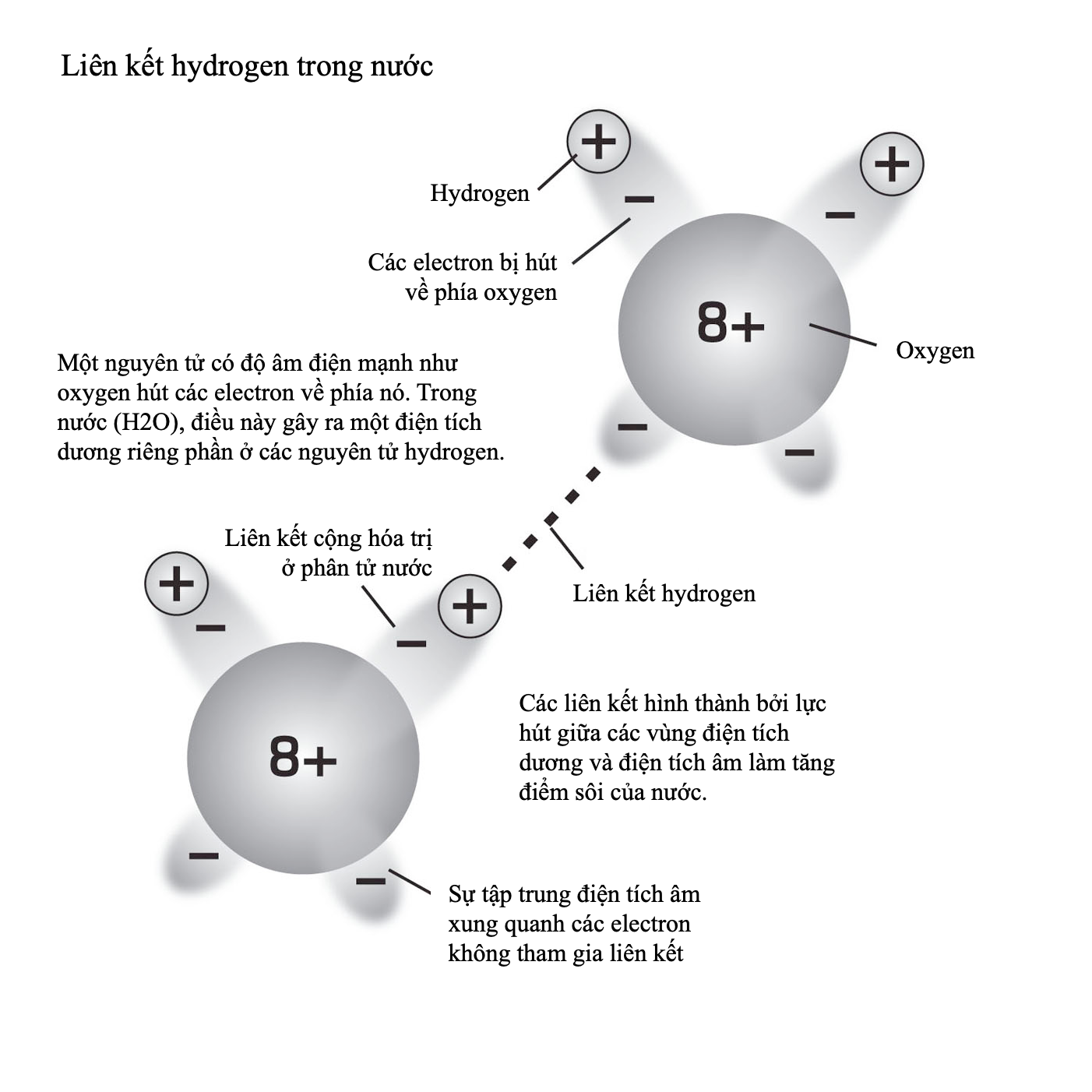
Điểm nóng chảy và điểm sôi
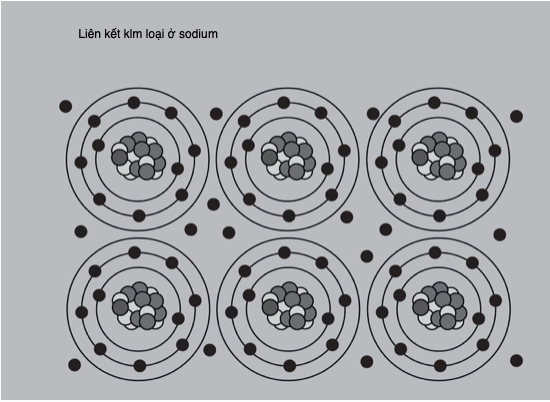
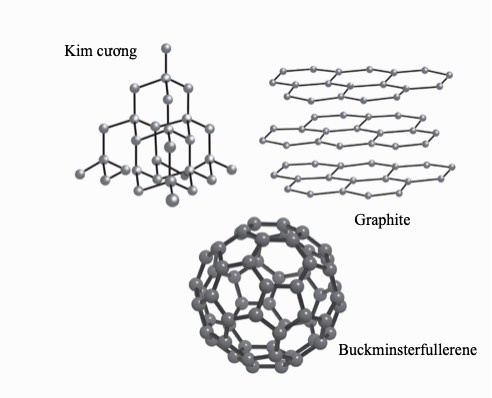
Điểm nóng chảy và điểm sôi là nhiệt độ tại đó các chất biến đổi trạng thái – tương ứng từ rắn sang lỏng, và từ lỏng sang hơi. Cả hai điểm đều có thể được xem là một số đo năng lượng liên kết giữ một chất lại, để xảy ra biến đổi pha thì phải vượt quá năng lượng này. Đối với các nguyên tử có các nguyên tử hình thành liên kết ion và liên kết kim loại, thì điểm nóng chảy và điểm sôi cao: chất rắn của chúng có lực tĩnh điện mạnh tác dụng theo mọi hướng, và lực hút giữa từng nguyên tử trong chất lỏng cũng có xu hướng mạnh. Trái lại, các chất liên kết cộng hóa trị có lực liên phân tử yếu nên chỉ cần một cú hích năng lượng nhẹ để biến thành thể lỏng. Helium, một chất khí lưỡng nguyên tử với lực hút không đáng kể giữa các phân tử, có điểm nóng chảy thấp nhất trong số mọi nguyên tố, gần sát không độ tuyệt đối. Nhưng nên thận trọng khi áp dụng quy tắc này rộng rãi – nguyên tố có điểm nóng chảy cao nhất hết thảy, carbon ở dạng kim cương của nó, cũng liên kết cộng hóa trị. Việc phá vỡ mạng tinh thể liên kết mạnh của kim cương đòi hỏi nhiệt độ 3.642oC (6.588oF), tại điểm đó nó thăng hoa, biến trực tiếp từ thể rắn sang hơi.

Độ âm điện
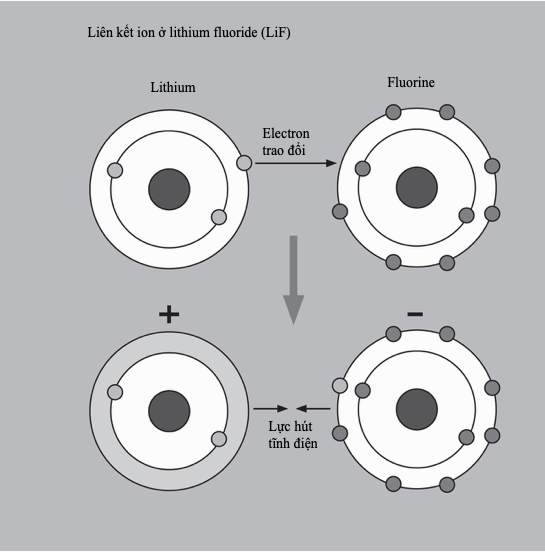
Độ âm điện mô tả ái lực electron của một nguyên tố - ‘tính tham lam’ của nó, hay mức nó hút lấy các electron và liên kết với chúng. Tính chất này thường được mô tả bởi từ ‘khả năng’ hay ‘mức sẵn sàng’: mặc dù, tất nhiên, các nguyên tử làm gì có cơ quan đại diện, nhưng chúng thường được cho là ‘muốn’ có một lớp vỏ electron điền đầy. Trên thực tế, tất nhiên, đây chẳng gì hơn là các sự kiện do năng lượng chi phối: nếu một cấu hình electron nhất định là bền hơn, thì một hệ sẽ tự nhiên ‘chiếm lấy’ nó.
Do bởi các nguyên tố kim loại ở phía trái của bảng tuần hoàn có các lớp vỏ hóa trị chưa đầy một nửa, nên để chúng có được một lớp vỏ đầy đòi hỏi nhiều năng lượng hơn là cho đi các electron và đạt tới bền vững theo cách giống như vậy. Do đó, các nguyên tố này có xu hướng đánh mất electron còn các nguyên tố ở bên phải thì nhận thêm electron. Từ trái sang phải của các chu kì, độ âm điện tăng, đồng thời nó giảm từ trên xuống dưới theo nhóm. Vì thế, nguyên tố có độ âm điện lớn nhất là fluorine ở gần góc trên bên phải. Với các lớp vỏ hóa trị điền đầy, các khí hiếm không có giá trị độ âm điện.
Bảng tuần hoàn hóa học tốc hành | Dan Green
Bản dịch của Thuvienvatly.com