Đầu thế kỉ 20 là thời khắc đầy triển vọng đối với các ngành khoa học. Ngoài việc Ernest Rutherford và Neils Bohr cho ra đời Mô hình Chuẩn của ngành vật lí hạt sơ cấp, đó là khoảng thời gian có các đột phá trong lĩnh vực cơ học lượng tử. Nhờ những nghiên cứu tiếp diễn về hành trạng của electron, các nhà khoa học bắt đầu đề xuất các lí thuyết nhờ đó các hạt sơ cấp này hành xử theo những cách bất chấp vật lí học Newton cổ điển.
Một ví dụ là Mô hình Đám mây Electron được đề xuất bởi Erwin Schrodinger. Nhờ mô hình này, các electron không còn được mô tả là các hạt chuyển động xung quanh một hạt nhân ở giữa trong một quỹ đạo cố định nữa. Thay vậy, Schrodinger đề xuất một mô hình theo đó các nhà khoa học chỉ có thể đưa ra những dự đoán nhất định cho vị trí của các electron. Do đó, vị trí của chúng chỉ có thể được mô tả là một phần của một ‘đám mây’ bao xung quanh hạt nhân nơi các electron có khả năng được tìm thấy.
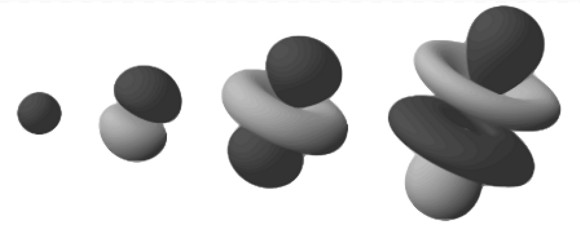
Mô hình 3D của các orbital electron, dựa theo mô hình đám mây electron. Ảnh: Wikipedia Commons
Vật lí học nguyên tử cho đến thế kỉ 20
Những thí dụ sớm nhất của thuyết nguyên tử có từ thời Hi Lạp và Ấn Độ cổ đại, nơi các nhà triết học như Democritus phát biểu rằng toàn bộ vật chất được cấu tạo bởi những đơn vị nhỏ xíu, không thể chia nhỏ và không thể phá hủy. Tên gọi “atom” (nguyên tử) được đặt theo tiếng Hi Lạp xưa và làm phát sinh trường phái tư tưởng gọi là “nguyên tử luận”. Tuy nhiên, lí thuyết này mang tính triết lí hơn là khoa học.

Các nguyên tử và phân tử được mô tả trong quyển Một hệ thống Triết lí hóa học mới của John Dalton (1808)
Mãi đến thế kỉ 19 thì thuyết nguyên tử mới được xem xét với tư cách một vấn đề khoa học, với những thí nghiệm chứng thực đầu tiên được tiến hành. Thí dụ, vào đầu thập niên 1800, nhà khoa học người Anh John Dalton đã sử dụng khái niệm nguyên tử giải thích tại sao các nguyên tố hóa học phản ứng theo những kiểu nhất định có thể quan sát và có thể dự đoán được. Qua một loạt thí nghiệm tiến hành với các chất khí, Dalton đi tới phát triển cái gọi là Thuyết nguyên tử Dalton.
Lí thuyết này mở rộng các định luật bảo toàn khối lượng và tam suất và suy giản gồm năm chi tiết: các nguyên tố, ở trạng thái tinh khiết nhất của chúng, gồm những hạt gọi là nguyên tử; các nguyên tử thuộc một nguyên tố nhất định đều giống nhau; các nguyên tử thuộc các nguyên tố khác nhau có thể phân biệt bởi trọng lượng nguyên tử của chúng; nguyên tử của các nguyên tố liên kết thành các hợp chất hóa học; các nguyên tử không được sinh ra hay phá hủy trong các phản ứng hóa học, chúng chỉ trao đổi nhóm liên kết.
Khám phá electron
Vào cuối thế kỉ 19, các nhà khoa học cũng bắt đầu lí thuyết hóa rằng nguyên tử được cấu tạo bởi nhiều hơn một đơn vị sơ cấp. Tuy nhiên, đa số các nhà khoa học liều lĩnh cho rằng đơn vị này sẽ tương đương cỡ với nguyên tử nhỏ nhất đã biết – nguyên tử hydrogen. Vào cuối thế kỉ 19, lí thuyết này có sự thay đổi kịch tính, nhờ nghiên cứu tiến hành bởi các nhà khoa học như Joseph John Thomson.
Qua một loạt thí nghiệm sử dụng ống tia cathode (gọi là Ống Crookes), Thomson quan sát thấy tia cathode có thể bị làm lệch hướng bởi điện trường và từ trường. Ông kết luận rằng thay vì là ánh sáng, tia cathode được cấu tạo bởi những hạt tích điện âm nhỏ hơn 1000 lần và nhẹ hơn 1800 lần so với nguyên tử hydrogen.
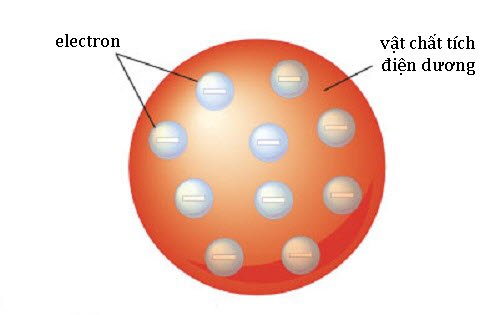
Mẫu nguyên tử bánh bông lan rắc nho
Kết luận này bác bỏ triệt để quan niệm cho rằng nguyên tử hydrogen là đơn vị nhỏ nhất của vật chất, và Thomson còn đi tới đề xuất rằng các nguyên tử là có thể chia nhỏ được. Để giải thích điện tích tổng thể của nguyên tử, gồm cả điện tích dương lẫn điện tích âm, Thomson đề xuất một mô hình theo đó các “tiểu thể” tích điện âm phân bố trong một biển đồng đều điện tích dương – gọi là Mô hình bánh bông lan rắc nho.
Những tiểu thể này về sau được đặt tên là “electron”, dựa trên hạt lí thuyết của nhà vật lí người Ireland George Johnstone Stoney hồi năm 1874. Và từ đây, Mô hình bánh lan rắc nho ra đời, sở dĩ gọi tên như thế vì nó trông na ná như món bánh nướng rải nhân nho của người Anh. Tên gọi electron ra mắt thế giới trong số ra tháng 3 năm 1904 của Tạp chí Triết học của Anh.
Phát triển Mô hình Chuẩn
Các thí nghiệm sau đó đã làm sáng tỏ một số hạn chế khoa học của Mô hình bánh bông lan rắc nho. Trước hết, có hạn chế của việc chứng minh nguyên tử có một phông nền tích điện dương đồng đều, cái gọi là “Bài toán Thomson”. 5 năm sau đó, mô hình bị bác bỏ bởi Hans Geiger và Ernest Marsden, họ tiến hành một loạt thí nghiệm sử dụng hạt alpha và lá vàng – tức là “thí nghiệm lá vàng”.
Trong thí nghiệm này, Geiger và Marsden đã đo phổ tán xạ của các hạt alpha bằng một màn hình huỳnh quang. Nếu mô hình của Thomson là đúng, thì các hạt alpha sẽ đi xuyên qua cấu trúc nguyên tử của lá vàng mà không bị cản trở gì. Tuy nhiên, họ để ý thấy trong khi phần lớn hạt bay xuyên qua, thì có một số hạt bị tán xạ theo những hướng khác nhau, với một số hạt bị bật ngược lại phía nguồn.
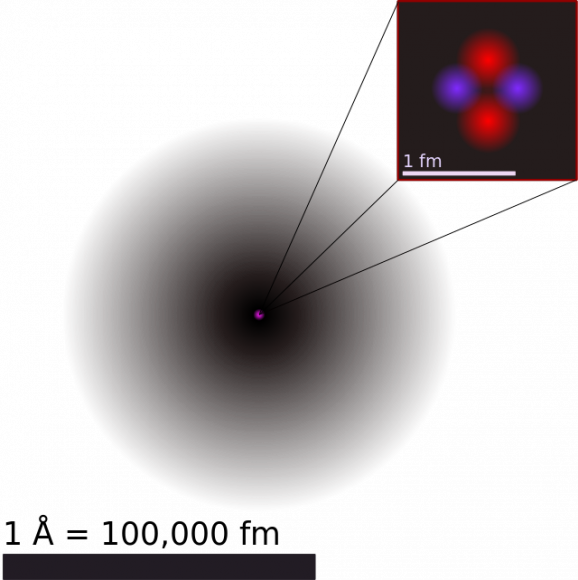
Minh họa cấu trúc của nguyên tử helium
Geiger và Marsden kết luận rằng các hạt alpha đã chịu một lực tĩnh điện lớn hơn nhiều so với mô hình Thomson cho phép. Vì hạt alpha chỉ là hạt nhân helium (mang điện dương), cho nên điều này hàm ý là điện tích dương trong nguyên tử không được phân bố rộng khắp, mà tập trung trong một thể tích nhỏ xíu. Ngoài ra, thực tế có những hạt đi xuyên qua dễ dàng mà không chệch hướng có nghĩa là những không gian mang điện dương này ngăn cách nhau bởi những khoảng không gian trống rỗng rất lớn.
Vào năm 1911, nhà vật lí Ernest Rutherford đã giải thích thí nghiệm Geiger-Marsden và bác bỏ mô hình nguyên tử của Thomson. Thay vào đó, ông đề xuất một mô hình trong đó nguyên tử gồm phần lớn không gian trống rỗng, với toàn bộ điện tích dương của nó tập trung tại tâm của nó trong một thể tích rất nhỏ, bao xung quanh là một đám mây electron. Mô hình này được gọi là Mô hình Rutherford của nguyên tử.
Các thí nghiệm do Antonius Van den Broek và Neils Bohr tiến hành sau đó đã trau chuốt thêm cho mô hình. Trong khi Van den Broek đề xuất rằng số nguyên tử của một nguyên tố rất giống với điện tích hạt nhân của nó, thì Neils Bohr đề xuất một mô hình kiểu hệ mặt trời của nguyên tử, trong đó hạt nhân chứa số nguyên tử điện tích dương và được bao xung quanh bởi số electron bằng như vậy trong các lớp vỏ orbital (tức là Mẫu Bohr).
Mô hình Đám mây Electron
Vào thập niên 1920, nhà vật lí người Áo Erwin Schrodinger trở nên bị cuốn hút bởi các nhà lí thuyết Max Planck, Albert Einstein, Niels Bohr, Arnold Sommerfeld, và các nhà vật lí khác. Trong khoảng thời gian này, ông còn nghiên cứu các lĩnh vực thuyết nguyên tử và quang phổ tại Đại học Zurich và sau đó tại Đại học Friedrich Wilhelm (nơi ông kế nhiệm Planck vào năm 1927).
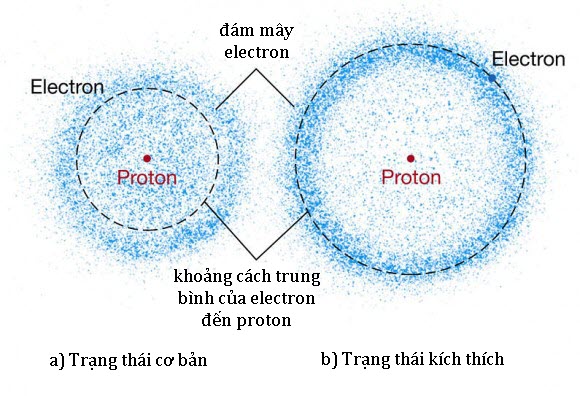
Ảnh minh họa mô hình đám mây electron
Năm 1926, Schrödinger đã giải bài toán các hàm sóng và electron trong một chuỗi bài báo. Ngoài việc mô tả cái về sau gọi là phương trình Schrodinger - một phương trình vi phân riêng phần mô tả trạng thái lượng tử của một hệ lượng tử biến đổi như thế nào theo thời gian - ông còn sử dụng các phương trình toán học mô tả khả năng tìm thấy một electron ở một vị trí nhất định.
Đây là cơ sở của cái gọi là Mô hình Đám mây Electron (hay mô hình cơ lượng tử), cũng như phương trình Schrodinger. Dựa trên lí thuyết này, nó phát biểu rằng toàn bộ vật chất có các tính chất đi kèm với một hàm sóng, Mô hình Đám mây Electron khác với Mô hình Bohr ở chỗ nó không định nghĩa quỹ đạo chính xác của mỗi electron.
Thay vậy, nó dự đoán vị trí tìm thấy electron dựa trên một hàm xác suất. Hàm xác suất đó căn bản mô tả một vùng giống đám mây trong đó electron có khả năng được tìm thấy, từ đó mà có tên gọi. Nơi đám mây dày đặc nhất thì xác suất tìm thấy electron là lớn nhất; và nơi electron ít có khả năng được tìm thấy hơn thì đám mây kém đặc hơn.
Những vùng dày đặc này được gọi là “orbital electron”, vì chúng là vị trí có khả năng nhất để tìm thấy một electron đang quay xung quanh hạt nhân. Mở rộng mô hình “đám mây” này sang không gian ba chiều, ta thấy một nguyên tử hình quả tạ hoặc hình bông hoa. Ở đây, các vùng tỏa nhánh là các vùng có khả năng cao nhất tìm thấy các electron.
Nhờ nghiên cứu của Schrodinger, các nhà khoa học bắt đầu hiểu rằng trong địa hạt cơ học lượng tử, người ta không thể biết chính xác vị trí và động lượng của mỗi electron đồng thời. Cho dù nhà quan sát ban đầu biết bao nhiêu về một hạt, họ cũng chỉ có thể dự đoán vị trí tiếp theo hay động lượng của nó theo xác suất mà thôi.
Tại một thời điểm cho trước, họ chỉ có thể biết chính xác một thông số mà thôi. Thật vậy, họ càng biết nhiều về động lượng của một hạt, thì họ sẽ biết càng ít về vị trí của nó, và ngược lại. Đây là cái ngày nay gọi là “Nguyên lí loại trừ”.
Lưu ý rằng các orbital đề cập trong đoạn trên được hình thành bởi một nguyên tử hydrogen (với chỉ một electron). Khi xử lí các nguyên tử có nhiều electron hơn, thì các vùng orbital electron phân tán đồng đều thành một quả cầu mờ nhạt. Đây là chỗ tên gọi “đám mây electron” là thích hợp nhất.
Đóng góp này được nhìn nhận là một trong những đóng góp đáng giá của thế kỉ 20, và là cái đã khơi mào một cuộc cách mạng trong các lĩnh vực vật lí, cơ học lượng tử và thật ra là mọi ngành khoa học. Kể từ đó, các nhà khoa học không còn làm việc trong một vũ trụ được đặc trưng bởi sự tuyệt đối của thời gian và không gian, mà trong các bất định lượng tử và sự tương đối thời gian-không gian.
Nguồn: Universe Today