Vào những năm đầu tiên của thế kỉ thứ VI trước Công nguyên (tCN), nhà triết học Hi Lạp Thales xứ Miletus (Hi Lạp, khoảng 624-546 tCN) tường thuật rằng cái ngày nay chúng ta gọi là điện tích có thể được “tạo ra”, hay nói chính xác hơn, được tích góp bằng cách cọ xát lông thú trên một số chất liệu, như hổ phách chẳng hạn. Hai mươi hai thế kỉ sau, năm 1600, nhà khoa học Anh William Gilbert (Anh, 1544-1603) cho xuất bản cuốn De magnete (gọi tắt), trong đó ông không chỉ khảo cứu về lực từ, mà ông còn đặt ra từ electricus từ tiếng Hi Lạp élektrikon, nghĩa là hổ phách.
Điện tích là một đặc tính cơ bản của vật chất. Nó là nguồn gốc và là đối tượng chịu tác dụng của một trong những tương tác cơ bản của tự nhiên, đó là tương tác điện từ. Như ta sẽ học được trong quyển sách này, các hiện tượng điện, hiện tượng từ, hiện tượng hóa học, và bản thân ánh sáng, đều là các hiện tượng điện từ. Nền văn minh của chúng ta lệ thuộc hoàn toàn vào điện từ học. Hãy nghĩ đến cuộc sống hàng ngày của chúng ta sẽ như thế nào nếu điện năng bị cắt vĩnh viễn.
Có hai loại điện tích, gọi là dương và âm. Các điện tích trái dấu thì hút nhau, các điện tích cùng dấu thì đẩy nhau. Lưu ý rằng “dương” và “âm” chỉ là tên gọi mà thôi; chúng không có nghĩa là các điện tích có đặc trưng toán học của số dương và số âm.
Một dụng cụ đơn giản để xác định bán-định lượng điện tích là điện nghiệm (electroscope), từ tiếng Hi Lạp skopeo, nghĩa là nhìn. Một điện nghiệm tiêu biểu, điện nghiệm lá vàng, do Abrham Bennet (Anh, 1749-1799) phát triển lần đầu tiên vào năm 1787, được trình bày trong Hình 1.1. Nó gồm một thanh dẫn thẳng đứng, làm bằng kim loại, thường là đồng thau. Đầu dưới của thanh treo hai lá vàng mỏng linh hoạt song song nhau, chúng được đặt trong một bình thủy tinh để bảo vệ khỏi bị xô đẩy bởi không khí. Bình thủy tinh có đế kim loại nối đất vì lí do an toàn. Đầu trên của thanh xuyên tiếp xúc vào một đĩa (hoặc quả cầu) kim loại, điện tích muốn đo sẽ được đặt trên cái đĩa này. Một phần điện tích này phân bố trên toàn bộ vật dẫn, đặc biệt, trên hai lá kim loại. Hai lá kim loại bị tích điện cùng dấu, chúng đẩy nhau, xòe thành hình chữ “V”, điện tích càng lớn thì chữ V xòe càng rộng. Bằng cách này, ta có một ước lượng, thay vì một phép đo định lượng, của điện tích. Hình 1.1 cũng cho thấy một thìa tĩnh điện, đó là một quả cầu kim loại nhỏ gắn với một tay cầm cách điện. Người ta dùng cái thìa này để lấy điện tích từ điểm kiểm tra (chẳng hạn, bề mặt một vật dẫn) đến điện nghiệm, bằng cách tuần tự chạm vào vật dẫn và rồi chạm vào cái đĩa gắn quả cầu của điện nghiệm.
Các thiết bị hoạt động trên nguyên lí giống như vậy, gọi là điện lượng kế, đã được phát triển để đo điện tích chính xác hơn.
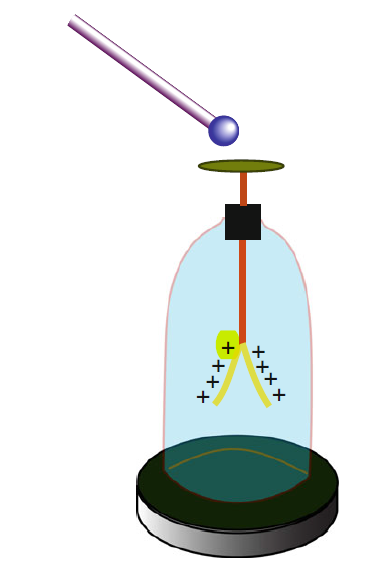
Hình 1.1 Điện nghiệm lá vàng và thìa tĩnh điện
Vật chất được cấu tạo bởi những hạt rất nhỏ, đó là các phân tử, rồi các phân tử lại được làm bằng các nguyên tử. Nguyên tử đặc trưng cho các nguyên tố, các phân tử và các chất hóa học. Các định luật vật lí ở cấp độ nguyên tử và dưới-nguyên tử có tính lượng tử hóa và không thể bàn luận ở mức độ của khóa học này. Như vậy, chúng ta sẽ không sa vào chi tiết, mà chỉ hạn chế trình bày với những thành tố cơ bản, tương tự như cái ta đã làm ở Chương 4 của tập hai của bộ sách này.
Mặc dù các nguyên tử là đối tượng sơ cấp trong phản ứng hóa học, nhưng chúng cũng có cấu trúc bên trong. Nguyên tử gồm một hạt nhân trung tâm mang điện dương, và các electron mang điện âm và tạo thành một “đám mây” xung quanh hạt nhân. Nguyên tử trung hòa điện; lực liên kết là lực điện từ. Hạt nhân nguyên tử cũng có cấu trúc bên trong; nó được làm bằng proton và neutron. Lực liên kết bên trong hạt nhân được gọi là lực hạt nhân mạnh. Proton và neutron cũng là những hạt phức; chúng được làm bằng quark, liên kết với nhau bởi cái gọi là lực màu, trong đó “màu” là một tên gọi hài hước mà các nhà vật lí đặt cho nó, tuy rằng nó chẳng liên quan gì đến thế giới màu sắc mà chúng ta biết. Nói cho chính xác thì lực hạt nhân mạnh là hệ quả của lực màu.
Kích cỡ hình học của nguyên tử, khác nhau từ loài nguyên tử sang loài nguyên tử khác, là kích cỡ của “đám mây” mang điện âm này. Bậc độ lớn của nó vào cỡ một phần mười của một nano-mét, hay 10-10 m. Đường kính hạt nhân nhỏ hơn bốn bậc độ lớn, từ 1 fm đến 10 fm (10-15 m - 10-14 m). Nếu ta phóng to một hạt nhân đến kích cỡ của một dấu chấm trên đầu chữ “i” trên trang này, thì nguyên tử sẽ có kích cỡ vài ba mét.
Số lượng electron (kí hiệu e), gọi là Z, đặc trưng cho nguyên tố, biến thiên từ 1 cho hydrogen đến 92 cho uranium trong bảng tuần hoàn Mendeleev, hệ thống mang tên của Dmitri Mendeleev (Nga, 1834-1907). Các electron trong nguyên tử hành xử theo các quy luật lượng tử, thay cho cổ điển. Đặc biệt, các electron không hề có quỹ đạo rõ ràng; ta không thể nói thích đáng về các quỹ đạo electron xung quanh hạt nhân (mặc dù điều này vẫn được nói ở nhiều sách vở). Các electron trong nguyên tử chuyển động rất nhanh so với các đối tượng vĩ mô; tốc độ của chúng vào bậc 104 m/s, tuy nhiên nó vẫn nhỏ hơn nhiều so với tốc độ ánh sáng. Thời gian đặc trưng của chuyển động electron nhỏ hơn nhiều so với thời gian phân giải của các thiết bị của chúng ta và, do đó, ta chỉ quan sát được cấu hình trung bình của nguyên tử. Ta thấy điện tích electron được phân bố liên tục trong một vùng xung quanh hạt nhân với mật độ lớn hơn ở chỗ xác suất tìm thấy một electron là lớn hơn, và nhòe hơn ở chỗ xác suất ấy là nhỏ hơn. Như vậy, ta có thể nghĩ tới một đám mây điện tích, mặc dù chỉ có một electron, như trong trường hợp hydrogen.
Hạt nhân nguyên tử được cấu tạo gồm proton (p) mang điện dương và neutron (n) trung hòa điện. Ngoài điện tích ra, proton và neutron rất giống nhau và được gọi chung là nucleon. Đối với mỗi nguyên tố, số lượng proton bằng số lượng electron. Proton và electron có điện tích bằng nhau và trái dấu; cho nên, như ta đã nói, các nguyên tử tổng thể trung hòa điện.
Điện tích proton và điện tích electron là điện tích nhỏ nhất tồn tại tự do trong tự nhiên, và được gọi là điện tích nguyên tố. Thật ra, các quark có điện tích nhỏ hơn. Nucleon gồm hai loại quark, gọi là up (u) và down (d). Điện tích lần lượt của chúng là 2/3 và -1/3 điện tích nguyên tố. Proton chứa 2 u và 1 d, neutron chứa 1 u và 2 d. Tuy nhiên, các quark không bao giờ tự do; chúng cư trú bên trong nucleon và những hạt cùng loại khác. Điện tích của tất cả những vật khác đều bằng bội số nguyên của điện tích nguyên tố. Người ta có thể xét phê chuẩn điện tích làm đơn vị, nhưng điều này bất tiện, vì những điện tích thường gặp sẽ được biểu diễn bởi những con số khổng lồ. Đơn vị của điện tích trong hệ SI là coulomb (C), ta sẽ sớm định nghĩa ở phần sau. Giá trị của điện tích nguyên tố là
qe = 1,6021766208(98) ´ 10-19 C (1.1)
trong đó hai chữ số trong dấu ngoặc là sai số của hai chữ số cuối của giá trị đã nêu. Ta sẽ mô tả, trong Mục 1.8, phép đo của Millikan về đại lượng nguyên tố này.
Giá trị của điện tích nguyên tố thường được sử dụng để định nghĩa một đơn vị năng lượng hữu ích ở cấp độ nguyên tử và phân tử, gọi là electronvolt. Electronvolt là động năng thu được bởi một electron rơi dưới hiệu điện thế một volt. Như vậy, giá trị bằng số của nó tính theo joule, bằng với điện tích nguyên tố, tức là xấp xỉ
1 eV » 1,60 ´ 10-19 J (1.2)
Sự có mặt của neutron trong hạt nhân là cần thiết để đảm bảo sự ổn định của nó. Bên trong hạt nhân, lực đẩy điện giữa các proton có xu hướng phá hủy nó. Tuy nhiên, lực hạt nhân là lực hút và, dưới những điều kiện tương tự, nó có cùng độ lớn giữa các protron, giữa các neutron, và giữa một proton và một neutron. Sự cân bằng giữa lực điện và lực hạt nhân xảy ra khi số lượng neutron có phần lớn hơn số lượng proton. Số lượng neutron nhiều hơn proton càng nhiều thì kích cỡ hạt nhân càng lớn. Số lượng neutron được kí hiệu là N, tổng số nucleon (proton và neutron) được kí hiệu là A (A = N + Z), A được gọi là số nguyên tử. Với mỗi loài nguyên tử nhất định (tức là với mỗi giá trị Z nhất định), có thể tồn tại nhiều hơn một loài hạt nhân với những giá trị N khác nhau, hệ quả là có những giá trị A khác nhau. Toàn bộ những loài này có tính chất hóa học giống nhau, và được bố trí chung trong một ô của bảng tuần hoàn Mendeleev. Vì lí do này, chúng được gọi là các đồng vị (isotopes, tiếng Hi Lạp nghĩa là chung một chỗ). Tỉ lệ của những đồng vị bền khác nhau của một nguyên tố trong tự nhiên là cố định.
Thí dụ, hydrogen có hai đồng vị bền: 1H (chỉ số trên là A), hạt nhân của nó chỉ là một proton, và 2H, deuteron, hạt nhân của nó gồm một proton và một neutron. Một đồng vị thứ ba, 3H, tritium, tồn tại nhưng không bền, có chu kì bán rã 12,32 năm. Nó liên tục được tạo ra bởi các va chạm tia vũ trụ trong khí quyển. Nguyên tố thứ hai là helium, nó có hai đồng vị bền, 3He (2p, 1n) và 4He (2p, 2n), và vân vân.
Bây giờ ta hãy xem các giá trị khối lượng. Khối lượng electron là
me = 9,10938356(11) ´ 10-31 kg (1.3)
Khối lượng proton lớn hơn 1836 lần, tức là bằng
mp = 1,672621898(21) ´ 10-27 kg (1.4)
Neutron có khối lượng gần như bằng, nhưng lớn hơn một chút, so với proton,
mn = 1,674927471(21) ´ 10-27 kg (1.5)
Từ những giá trị ở trên, ta thấy rằng phần lớn nhất của khối lượng nguyên tử, và theo đó là phần lớn nhất của khối lượng vật chất, tập trung ở hạt nhân. Đóng góp khối lượng của electron chỉ chiếm vài ba phần mười nghìn. Ta có thể nghĩ tới khối lượng nguyên tử bằng bội số nguyên lần của khối lượng proton. Đây chỉ là một phép gần đúng thô sơ, vì ba nguyên do sau đây. Thứ nhất, một số nguyên tố là hỗn hợp của những đồng vị khác nhau với giá trị A khác nhau, theo những tỉ lệ nào đó; thứ hai, khối lượng proton và khối lượng neutron là gần bằng nhau, chứ không hoàn toàn bằng nhau; thứ ba, khối lượng của hạt nhân không bằng tổng khối lượng của các nucleon của nó; khối lượng của nó hơi nhỏ hơn một chút do năng lượng liên kết, như đã trình bày ở Chương 6 của quyển tập 1.
Khối lượng của quark u và quark d lần lượt bằng khoảng hai phần nghìn và bốn phần nghìn của khối lượng nucleon. Điều này thật sự bất ngờ. Như vậy, phần lớn nhất của khối lượng nucleon, và do đó của khối lượng hạt nhân, của nguyên tử vật chất nói chung do đâu mà có? Câu trả lời nằm ở hành trạng rất đặc biệt của lực màu (lượng tử). Một mặt, nó tăng theo khoảng cách sao cho các quark không thể tách nhau ra; mặt khác, năng lượng liên kết của nó có giá trị dương và rất lớn. Vì thế, thay vì hụt khối lượng, như trong nguyên tử và hạt nhân, có sự thừa khối lượng trong các nucleon. Khối lượng của nucleon lớn hơn nhiều so với tổng khối lượng của các thành phần của nó. Sự thừa khối lượng này chiếm phần lớn nhất của khối lượng vật chất, kể cả chúng ta.
Trong chừng mực mà chúng ta biết, electron và quark không có cấu trúc bên trong và giống như chất điểm. Kích cỡ của chúng nhỏ hơn nhiều so với độ phân giải thực nghiệm, hiện nay là vào cỡ atto-mét (10-18 m). Nucleon có bán kính nhỏ hơn hạt nhân, nhưng có thể sánh với hạt nhân, cỡ 1 fm, và như chúng ta vừa nói chúng được cấu tạo bởi các quark. Trong phần thảo luận của chúng ta về điện môi, chất dẫn điện và vật liệu từ, ta sẽ chẳng cần biết chi tiết hơn làm gì về cấu trúc bên trong của hạt nhân.
Tóm lại, vật chất được cấu tạo bởi vô số thành phần sơ cấp rất nhỏ mang điện, với điện tích dương lẫn điện tích âm, chúng hòa quyện mật thiết và sít sao đến mức các tác động của chúng có giá trị rất lớn bên trong nguyên tử nhưng hầu như biến mất ở bên ngoài nguyên tử. Ta sẽ thấy rằng lực tương tác giữa các điện tích là giống với lực hấp dẫn, nhưng với cường độ mạnh hơn nhiều. Thực tế các tác động của chúng hầu như chẳng ai chú ý ở cấp vĩ mô là do sự triệt tiêu hoàn hảo của chúng ở cấp độ nguyên tử, đem lại sự trung hòa điện tổng thể của vật chất.
Q1.1 Điện tích của một mol electron bằng bao nhiêu?
Bảo toàn điện tích. Một tính chất cơ bản của điện tích là nó được bảo toàn. Điện tích không tự sinh ra hay hủy mất, hiểu theo nghĩa là điện tích toàn phần, hay tổng đại số của các điện tích dương và âm, là không thay đổi. Quả thật, một electron chẳng hạn có thể “hủy” với phản hạt của nó, tức positron, hạt có điện tích bằng về độ lớn và trái dấu với điện tích electron, với trạng thái cuối cùng là hai photon trung hòa điện. Nhưng điện tích ban đầu lẫn điện tích sau cùng đều có tổng bằng không. Tương tự như vậy, một quá trình trong đó một photon “vật chất hóa” thành một cặp electron-positron là có thể xảy ra, bởi vì điện tích tổng cộng được bảo toàn. Một thí dụ nữa là neutron, khi tự do ở bên ngoài hạt nhân, nó không bền. Thật vậy, neutron phân hủy bởi lực hạt nhân yếu thành một proton, một electron và một phản neutrino. Điện tích của chúng lần lượt là +qe, -qe và 0. Tổng điện tích được bảo toàn.
Lưu ý rằng khí người ta nói, có phần thô tục, về việc “tạo ra” điện tích, chẳng hạn bằng cách cọ xát lông thú lên hổ phách, như ta đã nói ở những dòng đầu tiên của mục này, ý người ta muốn nói đến việc tách rời một phần điện tích âm (ở lại trong lông thú) ra khỏi điện tích dương (ở lại trong hổ phách).
Trích Điện từ học (Alessandro Bettini)